| Parameter | Typische Ausprägung |
|---|---|
| Zugang | VATS mit 2 Trokaren (ca. 10–12 mm) |
| Druck in der Pleurahöhle | ca. 8–12 mmHg CO₂ |
| Temperatur intrathorakal | normotherm bis moderat hypertherm (ca. 39 °C) |
| Grundchemotherapeutikum | Cisplatin |
| Typischer Dosisbereich Cisplatin | etwa 7,5–70 mg/m² je nach Protokoll |
| Zusatzchemotherapeutikum (optional) | z. B. Doxorubicin in reduzierter Dosis |
| Trägervolumen | ca. 150–200 mL NaCl 0,9 % |
| Expositionszeit | ca. 30 Minuten Steady-State |
| Wiederholbarkeit | je nach Protokoll einmalig oder in 6-wöchigen Intervallen |
46 Pressurized Intrathoracic Aerosol Chemotherapy (PITAC/PITHAC)
Erstellt: 12.11.2025
Autoren: T. Jäger | J. Hutter | M. Lechner | K. Emmanuel
Konsentiert:
Letzte Änderung: 12.11.2025
Zuletzt bearbeitet von: T. Jäger
Version: 2.0.1
Pressurisierte intrathorakale Aerosolchemotherapie (häufig als PITAC/PITHAC bezeichnet) ist ein experimentelles, regionales Therapieverfahren zur Behandlung der pleuralen Karzinose bzw. des malignen Pleuraergusses. Zytostatika werden dabei als feiner Aerosolnebel unter moderatem Druck in die Pleurahöhle eingebracht, zum Teil bei moderater Hyperthermie. Ziel ist eine hohe lokale Wirkstoffkonzentration bei möglichst geringer systemischer Exposition und damit Verbesserung der lokalen Tumorkontrolle und Symptomkontrolle [1, 2].
CAVE: Nur im Studienkontext
- Pressurisierte intrathorakale Aerosolchemotherapie ist kein Standardverfahren.
- Durchführung nur in erfahrenen Zentren und prospektiven Protokollen/Studien.
- Systemische Standardtherapien (Chemo/Immuntherapie/Targeted Therapy) werden dadurch nicht ersetzt.
46.1 Indikation & Kontraindikation
46.1.1 Indikation (immer Tumorboard-Entscheidung)
Übergeordnetes Ziel ist die kontrollierte Behandlung des malignen Pleuraergusses und der pleuralen Karzinose, meist palliativ mit Option auf:
- Symptomkontrolle (Dyspnoe, Thoraxschmerzen)
- bessere lokale Tumorkontrolle
- ggf. immunologisches „Priming” in Kombination mit Systemtherapie [2]
Mögliche Indikationen (ausschließlich im Rahmen von Studien):
- Maligner Pleuraerguss / pleurale Karzinose, wenn gleichzeitig ein videothorakoskopischer Eingriff zur:
- Häufige Primärtumoren:
46.1.2 Kontraindikationen (typischer Rahmen – studienspezifisch prüfen)
Onkologische Konstellation
- Lebenserwartung < 3 Monate
- ausgeprägte, unkontrollierte Fernmetastasierung ohne lokale Zielsetzung
- fehlende Möglichkeit zur thorakoskopischen Ergussbehandlung
Patient:innenbezogene Faktoren
- ECOG > 2
- relevante Niereninsuffizienz (z. B. Kreatinin-Clearance < 60 mL/min) oder andere Konstellationen, die eine Cisplatin-Gabe nicht erlauben [2]
- dekompensierte Herzinsuffizienz, schwerwiegende pulmonale Vorerkrankungen mit Kontraindikation zur VATS
- bekannte schwere Platin-Neuro-/Ototoxizität oder Allergie
Therapiebezogene Faktoren
- kürzliche systemische Chemotherapie (platinspezifische Sperrfristen des Protokolls beachten)
- laufende Teilnahme an konkurrierenden interventionellen Studien
- fehlende Arbeitsschutz-/Hygienestrukturen für den Umgang mit Aerosolchemotherapie
46.2 Präoperative Vorbereitung
- Interdisziplinäres Tumorboard
- Indikationsstellung und Zieldefinition (Symptomlinderung vs. lokale Kontrolle).
- Festlegung der Einbettung in das Gesamttherapiekonzept (Systemtherapie, Radiatio).
- Indikationsstellung und Zieldefinition (Symptomlinderung vs. lokale Kontrolle).
- Diagnostik & Staging
- CT Thorax/Abdomen (± PET-CT) zur Erfassung:
- Ausmaß der pleuralen Karzinose
- Ergussmenge und Septierungen
- Fernmetastasen
- Ausmaß der pleuralen Karzinose
- Zytologie und/oder Biopsie (z. B. VATS-Pleuralbiopsie) zur histologischen Sicherung.
- CT Thorax/Abdomen (± PET-CT) zur Erfassung:
- Allgemeine Prä-OP-Abklärung
- Lungenfunktion (Spirometrie, ggf. DLCO)
- Kardiologische Risikostratifikation nach Komorbiditäten
- Basis-Labor: BB, Elektrolyte, Kreatinin/eGFR, Leberwerte, Gerinnung
- Lungenfunktion (Spirometrie, ggf. DLCO)
- Cisplatin-Spezifika
- Dokumentation früherer Platindosen und -intervalle
- Nierenfunktionsprüfung (z. B. Cockcroft-Gault); Studienprotokoll fordert meist Kreatinin-Clearance ≥ 60 mL/min [2].
- Dokumentation früherer Platindosen und -intervalle
- Aufklärung
- Experimenteller Charakter, keine etablierte Überlebensverbesserung nachgewiesen [2].
- Potenzielle Vorteile: lokale Kontrolle, Symptomlinderung.
- Risiken: Nephro-, Oto-, Neurotoxizität, pulmonale und pleurale Komplikationen, Belastung durch VATS-Eingriff.
- Experimenteller Charakter, keine etablierte Überlebensverbesserung nachgewiesen [2].
46.3 Material & Instrumente
- Thorakoskopie
- 2 × 10–12 mm Trokare (oft Ballontrokar) im 5.–7. ICR
- Standard-VATS-Instrumentarium (Kamera, Greifer, Biopsiezangen, Koagulation)
- 2 × 10–12 mm Trokare (oft Ballontrokar) im 5.–7. ICR
- Aerosolsystem
- Chemotherapeutika (Beispiele aus Protokollen)
- Sicherheit & Arbeitsschutz
- geschlossene Aerosol-/Rauchevakuation mit HEPA-Filter
- Thoraxdrainage (z. B. 24 Ch, postero-apikal)
- persönliche Schutzausrüstung: FFP2/3-Maske, Schutzbrille/Visier, flüssigkeitsdichter Kittel, doppelte Handschuhe.
- geschlossene Aerosol-/Rauchevakuation mit HEPA-Filter
46.4 Anästhesie & Lagerung
- Anästhesie
- Allgemeinanästhesie mit Doppellumentubus
- Einlungenventilation auf der Gegenseite
- Invasive arterielle Blutdruckmessung, ggf. ZVK nach Risiko
- Regionalanästhesie (Epidural, Paravertebral, ESP-Block) zur Analgesie analog zu anderen VATS-Eingriffen.
- Allgemeinanästhesie mit Doppellumentubus
- Lagerung
- Seitenlage wie bei Standard-VATS
- sorgfältige Polsterung, freie Beweglichkeit des Thorax für Lageänderungen bei Bedarf.
- Seitenlage wie bei Standard-VATS
- Besonderheiten
- Klare Kommunikation zwischen OP- und Anästhesieteam über Start und Ende der Aerosol-Phase („Saal-sperre”).
- Temperaturmanagement:
- normotherm bis moderat hypertherm (ca. 39 °C) je nach Protokoll [2].
- Klare Kommunikation zwischen OP- und Anästhesieteam über Start und Ende der Aerosol-Phase („Saal-sperre”).
46.5 OP-Technik / Schritte
46.5.1 1. Thorakoskopischer Zugang & Exploration
46.5.2 2. Standardprozedur zur Ergusskontrolle
- je nach individueller Zielsetzung:
- Talkpleurodese oder
- Anlage eines getunnelten Dauerkatheters.
- Talkpleurodese oder
- Diese Prozeduren werden ergänzt, nicht ersetzt.
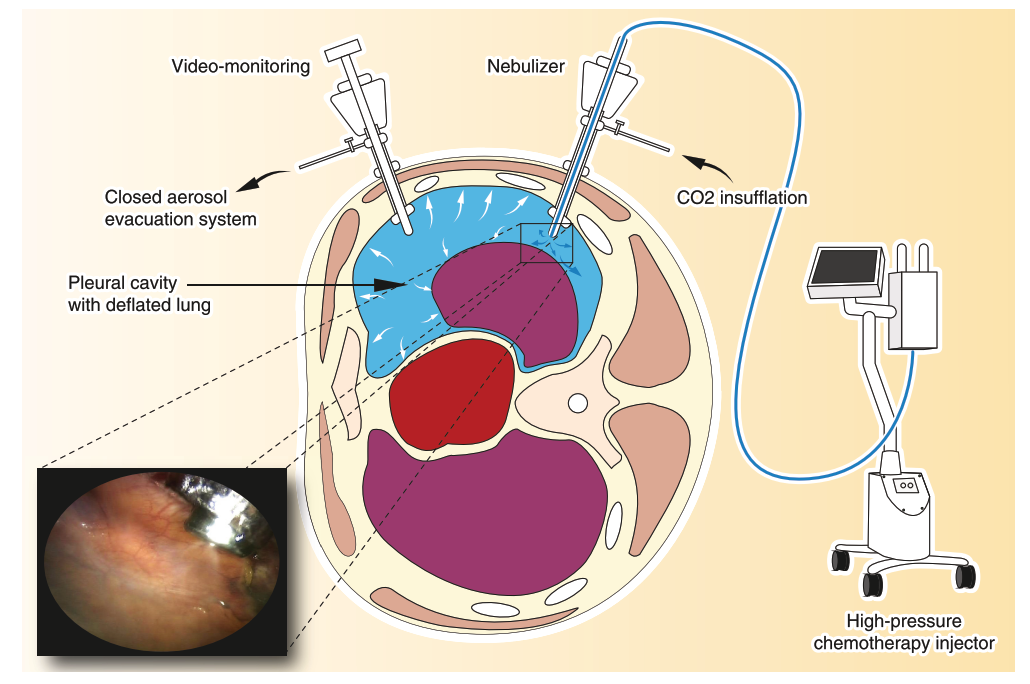
46.5.3 3. Vorbereitung der Aerosolchemotherapie
- Positionierung des Nebulizers über einen Trokar, Lagekontrolle mit der Kamera.
- CO₂-Insufflation auf ca. 8–12 mmHg intrathorakalen Druck.
- Vorbereitung der Chemotherapie:
46.5.4 4. Aerosol-Applikation & Expositionsphase
46.5.5 5. Evakuation & Thoraxdrainage
- Rückkehr des Teams mit kompletter Schutzausrüstung.
- Evakuation des Aerosols über ein geschlossenes Filtersystem.
- Einlage einer Thoraxdrainage (z. B. 24 Ch, postero-apikal) und Anschluss an Sog (z. B. −20 cmH₂O).
- Kontrolle der Lungenreexpansion, ggf. weitere Drainage.
- Standardgerechter Verschluss der Thorakoskopie-Inzisionen.
46.5.6 6. Wiederholungsschemata
- Je nach Studienprotokoll:
46.6 Typische Parameter einer pressurisierten intrathorakalen Aerosolchemotherapie
Im Text kann bei Bedarf auf „siehe Tabelle Table 46.1” verwiesen werden.
46.7 Intraoperative Komplikationen & Management
- Hämodynamische Instabilität
- Ursachen: CO₂-Pneumothorax, intrathorakaler Druck, systemische Resorption von Cisplatin, Temperaturveränderungen.
- Therapie: Anpassung des CO₂-Drucks, Volumentherapie, Vasopressoren, ggf. Verkürzung oder Abbruch der Expositionsphase [2].
- Ursachen: CO₂-Pneumothorax, intrathorakaler Druck, systemische Resorption von Cisplatin, Temperaturveränderungen.
- Ventilationsprobleme
- Tubusfehlposition, Desaturationen bei Einlungenventilation.
- Maßnahmen: Lagekontrolle des Doppellumentubus, temporäre bilaterale Ventilation, Anpassung von PEEP/FiO₂.
- Tubusfehlposition, Desaturationen bei Einlungenventilation.
- Aerosol-/Chemoleckage
- Risiko bei undichten Trokaren oder Anschlüssen.
- Prävention: Ballontrokar, Fixation, Checkliste vor Start der Aerosolgabe [1].
- Management: sofortige Unterbrechung, Dekontamination, ggf. Protokollabbruch.
- Risiko bei undichten Trokaren oder Anschlüssen.
- Blutung/Organverletzung
- Standardrisiko der VATS (Gefäße, Lunge, Zwerchfell).
- Konsequente Hämostase vor Beginn der Aerosolphase, gute Visualisierung aller Instrumente.
- Standardrisiko der VATS (Gefäße, Lunge, Zwerchfell).
46.8 Postoperatives Management
- Überwachungsniveau
- je nach Komorbidität und intraoperativem Verlauf:
- Aufwachraum mit erweiterten Monitoringoptionen bis hin zu IMC/Intensivstation für 24 h, insbesondere bei höherdosiertem Cisplatin und Hyperthermie [2].
- je nach Komorbidität und intraoperativem Verlauf:
- Nierenfunktion & Flüssigkeit
- engmaschige Bilanzierung der Diurese (Ziel z. B. ≥ 0,5–1 mL/kg/h)
- tägliche Kontrolle von Kreatinin, Elektrolyten, ggf. mehrmals in den ersten 48–72 h
- Vermeidung weiterer nephrotoxischer Substanzen wenn möglich.
- engmaschige Bilanzierung der Diurese (Ziel z. B. ≥ 0,5–1 mL/kg/h)
- Schmerztherapie & Atemtherapie
- Nutzung von Regionalanästhesie + systemischer Analgesie.
- Frühmobilisation, Atemphysiotherapie, Incentive-Spirale zur Vermeidung von Atelektasen.
- Nutzung von Regionalanästhesie + systemischer Analgesie.
- Drainagemanagement
- tägliche Dokumentation von Fördermenge, Farbe, Luftleck.
- Entfernung bei geringer Fördermenge und vollständiger Lungenentfaltung.
- tägliche Dokumentation von Fördermenge, Farbe, Luftleck.
- Arbeitsschutz nach der OP
- beim Umgang mit Drainagen:
- Schutzkittel, doppelte Handschuhe, Schutzbrille
- geschlossene Entsorgungssysteme für Sekrete
- Schutzkittel, doppelte Handschuhe, Schutzbrille
- Dauer der verstärkten Maßnahmen: mindestens 24–48 h (lokale Richtlinien).
- beim Umgang mit Drainagen:
46.9 Nachsorge & Kontrolle
- Kurzfristige Kontrollen
- Klinische Symptomatik (Dyspnoe, Thoraxschmerzen; z. B. numerische Rating-Skalen) vor und nach dem Eingriff.
- Röntgen-Thorax bzw. CT zur Beurteilung:
- Rest-/Rezidiverguss
- Pleuraspalt, Pneumothorax, Atelektasen [2].
- Rest-/Rezidiverguss
- Klinische Symptomatik (Dyspnoe, Thoraxschmerzen; z. B. numerische Rating-Skalen) vor und nach dem Eingriff.
- Mittel- und Langzeitnachsorge
- onkologisch nach Leitlinie der Grunderkrankung (Systemtherapie, Bildgebung, Labor).
- Fokussierte Frage nach Spättoxizität:
- Nierenfunktion, Neuropathie, Hörminderung (Cisplatin).
- Nierenfunktion, Neuropathie, Hörminderung (Cisplatin).
- Erneutes Tumorboard bei Rezidiverguss:
- erneute lokale Maßnahme (Pleurodese/Katheter ± erneute Aerosoltherapie im Studienrahmen)
- rein palliative Symptomkontrolle.
- erneute lokale Maßnahme (Pleurodese/Katheter ± erneute Aerosoltherapie im Studienrahmen)
- onkologisch nach Leitlinie der Grunderkrankung (Systemtherapie, Bildgebung, Labor).
46.10 Komplikationen & Prognose
46.10.1 Typische Komplikationen
- Frühkomplikationen
- Pneumonie, Atelektasen
- prolongiertes Luftleck, Pleuraspalt
- Wundheilungsstörungen
- Übelkeit, Erbrechen, Fatigue
- vorübergehende Nierenfunktionsverschlechterung [2].
- Pneumonie, Atelektasen
- Spätkomplikationen
- postthorakoskopisches Schmerzsyndrom
- persistierende Ventilationseinschränkung
- Spätnephrotoxizität bei kumulativer Platindosis.
- postthorakoskopisches Schmerzsyndrom
46.10.2 Prognostische Einordnung
- Aktuelle Daten (kleine Serien, frühe Phase-I/II-Studien) zeigen:
- Keine belastbare Evidenz für einen gesicherten Überlebensvorteil;
- Schwerpunkt liegt derzeit auf Symptomkontrolle, pharmakokinetischer Charakterisierung und möglichen immunologischen Effekten [2].
- Die pressurisierte intrathorakale Aerosolchemotherapie ist daher:
- Add-on zu etablierten lokalen Verfahren (Pleurodese/Katheter)
- integraler Bestandteil von Studienkonzepten, nicht von Standardleitlinien.
- Add-on zu etablierten lokalen Verfahren (Pleurodese/Katheter)